FDA и ЕС снова расширяют Соглашение о взаимном признании!

31 мая 2023 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Европейский союз (ЕС) объявили о расширении секторального приложения U.S.-EU соглашения о взаимном признании (MRA) для надлежащей фармацевтической производственной практики (GMP). Это расширение теперь включает инспекции ветеринарных фармацевтических препаратов, также известных как «лекарства для животных».
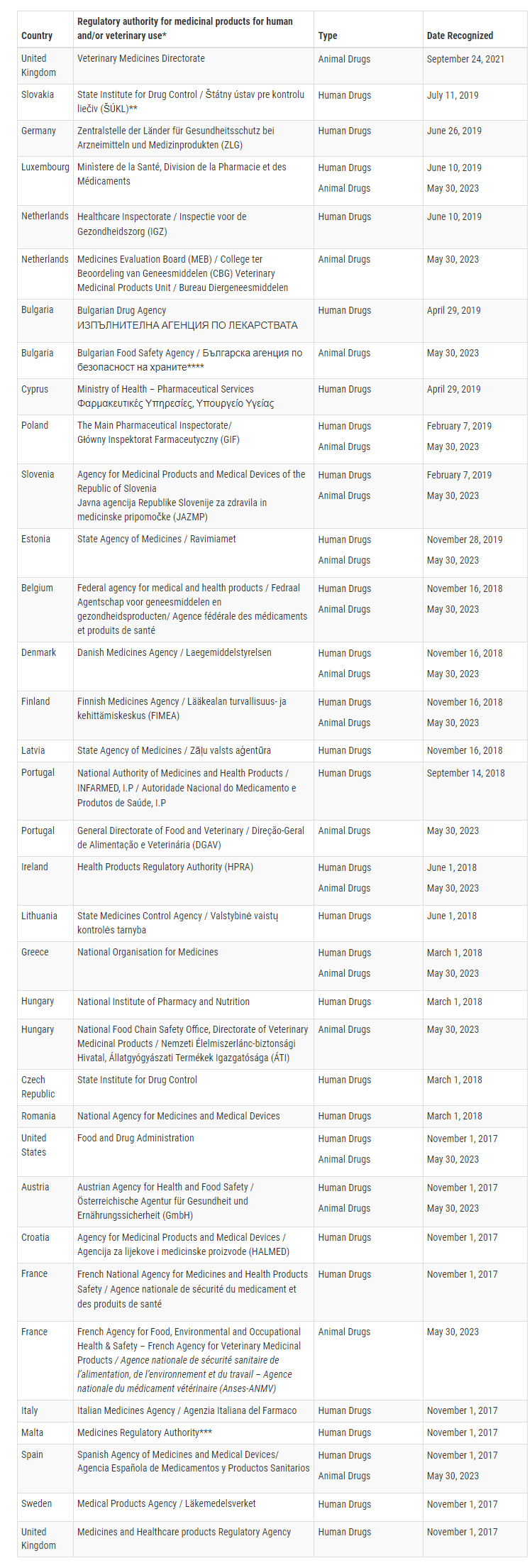
В настоящее время FDA подтвердило, что 16 государств-членов Европейского Союза способны проводить проверки GMP для конкретных ветеринарных продуктов на уровне, эквивалентном Соединенным Штатам. Этими государствами-членами являются Австрия, Бельгия, Болгария, Венгрия, Греция, Дания, Ирландия, Испания, Люксембург, Нидерланды, Польша, Португалия, Словения, Финляндия, Франция и Эстония.
Благодаря этому расширенному MRA FDA может полагаться на проверки GMP, проводимые этими 16 государствами-членами для предприятий ветеринарной продукции, в то время как Европейский Союз будет полагаться на инспекции, проводимые FDA. Это взаимное признание расширяет сотрудничество в области регулирования и упрощает надзор за ветеринарными фармацевтическими препаратами между FDA и ЕС.
Что такое MRA?
Соглашения о взаимном признании (MRA) облегчают сотрудничество между FDA и иностранными регулирующими органами, позволяя инспекторам по наркотикам полагаться на инспекционную информацию, проводимую в юрисдикциях друг друга. Закон о безопасности и инновациях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, введенный в действие в 2012 году, предоставляет FDA право заключать соглашения о признании проверок лекарств, проводимых иностранными регулирующими органами, отвечающими требованиям США.
СВП служат двум ключевым целям:
1. Повышение эффективности: избегая дублирования проверок, MRA продвигают оптимизированные процессы как для американских, так и для иностранных систем регулирования.
2. Распределение ресурсов: MRA позволяют перераспределить ресурсы, чтобы сосредоточиться на проверке предприятий по производству лекарств с потенциально более высокими рисками для здоровья населения во всем мире.
Кто подписал MRA с FDA?
В настоящее время FDA имеет MRA с Европейским союзом (ЕС) и Соединенным Королевством (Великобритания). Кроме того, 12 января 2023 года FDA подписало MRA со Швейцарией. Однако, прежде чем этот MRA вступит в силу, FDA должно оценить возможности инспекции Швейцарии, чтобы убедиться, что они соответствуют требованиям США. Аналогичным образом Швейцарское агентство по терапевтическим продуктам (Swissmedic) должно оценить соответствие FDA требованиям Швейцарии.

Ограничения
В настоящее время оценки возможностей относятся к плановой проверке наблюдения. Тем не менее, после дальнейшей оценки в соглашение могут быть включены следующие типы продуктов и инспекций:
1. Вакцины для использования человеком
2. Фармацевтические препараты плазменного производства
3. Исследовательские продукты (материалы для клинических испытаний), характерные для каждого соглашения
FDA и Великобритания обсудили возможность расширения сферы действия MRA, включив в него вакцины и фармацевтические препараты на основе плазмы для использования человеком. Решение по этому поводу будет пересмотрено в июле 2025 года после проведения дополнительных оценок.
Точно так же FDA и ЕС также изучили возможность расширения MRA за счет включения вакцин и фармацевтических препаратов, полученных из плазмы, для использования людьми. FDA пересмотрит этот вопрос в июле 2025 года, учитывая результаты дальнейших оценок.
Из области MRA исключены: лекарственные препараты для передовой терапии (ATMP), человеческая кровь, человеческая плазма, человеческие ткани и органы, клетки (Swissmedic MRA) и ветеринарные иммунологические препараты.
PS: Если вы хотите, чтобы наша команда настроила новый продукт домашнего хозяйства с FDA, MDR, ISO, FSC и т. Д., Пожалуйста, свяжитесь с нами.Insights@medasiagroup.com
МЫ РЕКОМЕНДУЕМ
Похожие статьи
- Подписаться MedInsights
- Подписаться MedInsights
- Подписаться MedInsights
- Подписаться MedInsights
- Подписаться MedInsights












